搞懂疫苗不良反應(yīng),看這篇就夠了
盡可能讓大家理解疫苗的作用機(jī)制,盡可能公布疫苗接種的相關(guān)數(shù)據(jù),讓大家明白疫苗帶來(lái)的獲益遠(yuǎn)高于風(fēng)險(xiǎn),是增強(qiáng)對(duì)免疫接種信心的重點(diǎn)。
2021年2月25日,又有2款國(guó)產(chǎn)新冠疫苗獲得國(guó)家藥品監(jiān)督管理局(NMPA)批準(zhǔn)上市,分別是康希諾生物股份公司的重組新型冠狀病毒疫苗(5型腺病毒載體)和國(guó)藥中生武漢公司的新型冠狀病毒滅活疫苗(Vero細(xì)胞)。截至目前,我國(guó)已經(jīng)官宣了4款新冠疫苗。同日,復(fù)星醫(yī)藥和BioNTech公司的mRNA新冠疫苗(注:即輝瑞/BioNTech的mRNA疫苗,復(fù)星醫(yī)藥獲得該疫苗在中國(guó)的授權(quán))也獲得中國(guó)澳門特別行政區(qū)衛(wèi)生局特別許可進(jìn)口批準(zhǔn)。隨著多款新冠疫苗相繼獲批,人類在抗擊新冠疫情方面將迎來(lái)新的局面。
國(guó)內(nèi)外已經(jīng)有相當(dāng)數(shù)量的人群接種了新冠疫苗,有效性和安全性的數(shù)據(jù)也相繼公布,結(jié)果理想。但是,對(duì)于更多的人們來(lái)說(shuō),與疫苗的保護(hù)力相比,疫苗不良反應(yīng)、尤其是嚴(yán)重不良反應(yīng)的報(bào)道更容易觸動(dòng)神經(jīng)。打,還是不打,這是個(gè)問(wèn)題!
接種疫苗為何會(huì)出現(xiàn)不良反應(yīng)?
那還要先從免疫的種類說(shuō)起
免疫的種類可以分為兩大類:
一、非特異性免疫
又稱天然免疫或先天免疫,它是機(jī)體生來(lái)就有的天然防御機(jī)制,不是某一個(gè)體所特有的,也不是專門針對(duì)某一個(gè)抗原性“異物”發(fā)揮作用。這種類型的免疫“不長(zhǎng)記性”,如果再次接觸同一抗原,會(huì)出現(xiàn)相似的反應(yīng)。我們稱為“缺乏免疫記憶”。
非特異性免疫系統(tǒng)包括:1、皮膚、黏膜等免疫屏障;2、溶菌酶、急性期蛋白、補(bǔ)體、細(xì)胞因子等免疫分子;3、吞噬細(xì)胞、單核細(xì)胞等免疫細(xì)胞。
二、特異性免疫
所謂“特異性”,就是“專門針對(duì)”的意思。淋巴細(xì)胞能夠特異性地識(shí)別抗原性“異物”,然后其自身活化、增生和分化,分泌特異性抗體,清除“異物”以及受損的細(xì)胞。
這是一種后天獲得的免疫,分為細(xì)胞免疫和體液免疫。前者由T淋巴細(xì)胞介導(dǎo);后者由抗體介導(dǎo)。抗體是B淋巴細(xì)胞合成和分泌的免疫效應(yīng)分子。
接種疫苗后的免疫反應(yīng),就是讓人體產(chǎn)生對(duì)某種特殊病原微生物的特異性抵抗力,并有免疫記憶。也就是說(shuō),人體能“記住”自己得過(guò)的病,再次接觸同一抗原后,能引起快速、強(qiáng)烈的免疫反應(yīng),從而發(fā)揮保護(hù)效力。
接種疫苗后的不良反應(yīng)
也從免疫的兩種類型來(lái)說(shuō)
一、非特異性免疫損害
在接種疫苗后,有些人注射的地方會(huì)紅腫,淋巴結(jié)會(huì)腫大、疼痛、有硬結(jié);還有的人會(huì)發(fā)熱、頭痛、頭暈、乏力、全身不適。這些局部的或全身性的炎癥反應(yīng),都屬于接種疫苗后的非特異性免疫損害。
這是因?yàn)椋瑐鹘y(tǒng)的疫苗大多數(shù)是對(duì)病原微生物或其糖分子、蛋白質(zhì)分子亞單位進(jìn)行滅活、減毒、提純等方法制成的,所以這些疫苗本身就包含一些固有的生物學(xué)特性,比如有毒性、含有菌體蛋白以及代謝產(chǎn)物,這樣就可能引發(fā)非特異性免疫反應(yīng)。
此外,在疫苗產(chǎn)品中,除了病原微生物或其亞單位成分,還會(huì)包含穩(wěn)定劑、防腐劑、吸附劑等。對(duì)于人體來(lái)說(shuō),這些都是“外來(lái)異物”,都有可能引起非特異性免疫反應(yīng)。
二、特異性免疫損害
既然有非特異性的,自然也有特異性的免疫損害。它的學(xué)名叫超敏反應(yīng),也稱變態(tài)反應(yīng)、過(guò)敏反應(yīng)。
正常情況下,人體的特異性免疫系統(tǒng)在接觸“外來(lái)異物”后,可以清除“外來(lái)異物”,同時(shí)也能保持內(nèi)環(huán)境的相對(duì)穩(wěn)定。超敏反應(yīng),顧名思義,就是對(duì)外來(lái)異物的反應(yīng)過(guò)度,結(jié)果引發(fā)生理功能紊亂或組織細(xì)胞損傷。超敏反應(yīng),通常是人體對(duì)抗原初次應(yīng)答后,再次接觸相同抗原后所引起的反應(yīng)。
超敏反應(yīng)的具體發(fā)病機(jī)制較為復(fù)雜,臨床表現(xiàn)各異。簡(jiǎn)單來(lái)說(shuō),從疫苗接種后幾秒鐘、幾小時(shí)、幾天、甚至幾周,都可能會(huì)發(fā)生超敏反應(yīng),可以表現(xiàn)為皮疹、過(guò)敏性鼻炎、蕁麻疹、瘙癢等,嚴(yán)重時(shí)可出現(xiàn)喉頭水腫、過(guò)敏性休克,甚至死亡。

反應(yīng)過(guò)度丨圖片來(lái)源:微博@假面貓耳
第一個(gè)問(wèn)題來(lái)了,超敏反應(yīng)是“再次接觸相同抗原后”才會(huì)引起的反應(yīng),為何有些人第一次接種疫苗后就會(huì)發(fā)生超敏反應(yīng)呢?
的確,如果一個(gè)人沒有接觸過(guò)某一種病原體,那基本上不會(huì)對(duì)該病原體發(fā)生超敏反應(yīng)。因此,除了極少的特殊情況外,第一次接種疫苗后出現(xiàn)的超敏反應(yīng),一般和疫苗中的病原微生物或其亞單位成分無(wú)關(guān),而是由疫苗產(chǎn)品中的其他成分所導(dǎo)致的。上文中也已經(jīng)提到,疫苗產(chǎn)品中還會(huì)包含穩(wěn)定劑、吸附劑、防腐劑等,那主要都包含哪些成分呢?
培養(yǎng)基:部分疫苗是以雞蛋或雞胚為培養(yǎng)基制備的,因此對(duì)雞蛋過(guò)敏的人群接種后會(huì)出現(xiàn)超敏反應(yīng)。
明膠:明膠是許多疫苗的增容劑和熱穩(wěn)定劑,由動(dòng)物膠原水解得到,來(lái)源于牛、豬等動(dòng)物的皮、骨、腱等。
硫柳汞:硫柳汞是一種含乙基汞的有機(jī)化合物,自20世紀(jì)30年代起被廣泛用作疫苗的防腐劑。
抗生素:部分疫苗含有微量的抗生素,例如新霉素、鏈霉素、多粘菌素等。
乳膠:主要存在于疫苗產(chǎn)品的容器或注射器中,乳膠含有植物蛋白和肽類雜質(zhì),可導(dǎo)致超敏反應(yīng)。
佐劑:佐劑是指能與抗原結(jié)合,促進(jìn)抗原作用的非特異性免疫增強(qiáng)劑,常用的有鋁鹽、皂苷(QS-21)、胞壁酸二肽/三肽、單磷酸脂質(zhì)A、細(xì)胞因子等。疫苗產(chǎn)品中使用的佐劑不一定是單種成分,也可以是多種成分復(fù)配后獲得。(詳細(xì)了解可閱讀《疫苗中的奇妙成分》)
除了以上談及的傳統(tǒng)疫苗,今年還有兩種新的疫苗:mRNA疫苗和腺病毒載體疫苗。
從理論上來(lái)說(shuō),mRNA本身不會(huì)引起特異性免疫。那么,除了mRNA以外,疫苗中還有哪些成分呢?根據(jù)輝瑞和BioNTech向美國(guó)食品和藥品監(jiān)督管理局(FDA)提交的信息,我們得知,這款mRNA疫苗中還包括脂質(zhì)納米顆粒(LNP)(注:將mRNA運(yùn)送到人體內(nèi)的載體物質(zhì))以及一些化學(xué)物質(zhì),包括氯化鉀、磷酸二氫鉀、氯化鈉、磷酸氫二鈉二水合物和蔗糖,并且不含有雞蛋成分、防腐劑、乳膠等。[1]

Pfizer-BioNTech與Moderna疫苗的成分比較[2](作者漢化)
腺病毒載體疫苗的情況則較為復(fù)雜。腺病毒是一種無(wú)包膜的雙鏈DNA病毒,可以感染呼吸道、眼部、胃腸道,免疫功能正常的人感染后,多數(shù)可以自我恢復(fù)。全球范圍內(nèi),已經(jīng)有相當(dāng)比例的人群體內(nèi)存在腺病毒抗體,就是說(shuō)已經(jīng)具有預(yù)先存在的免疫力。“預(yù)存免疫”是否會(huì)影響疫苗的效果,也是領(lǐng)域內(nèi)所關(guān)注的問(wèn)題。
不過(guò),腺病毒載體本質(zhì)上還是“外來(lái)異物”,是能夠刺激人體產(chǎn)生非特異性/特異性免疫反應(yīng)的。2021年2月27日,美國(guó)FDA批準(zhǔn)了強(qiáng)生公司的腺病毒載體新冠疫苗,根據(jù)FDA公布的信息,除了載體以外,包括一水檸檬酸、檸檬酸鈉二水合物、乙醇、2-羥丙基-β-環(huán)糊精(HBCD)、聚山梨酯-80、氯化鈉,同樣不含有雞蛋成分、防腐劑和乳膠[3]。2021年3月11日,強(qiáng)生公司的腺病毒疫苗在歐盟也獲得批準(zhǔn)。康希諾腺病毒新冠疫苗的其余成分信息較少。
第二個(gè)問(wèn)題也來(lái)了,部分疫苗需要接種多次(注:包括科興新冠滅活疫苗和復(fù)星新冠mRNA疫苗),如果接種第一針時(shí),沒有出現(xiàn)明顯的不良反應(yīng),那第二針會(huì)有不良反應(yīng)嗎?
答案是:也有可能!
不論是疫苗的病原微生物或其組分本身,還是疫苗中的其他成分,都可能成為致敏原。阿瑟氏(Arthus)反應(yīng),就是多次重復(fù)接種疫苗時(shí)可能會(huì)出現(xiàn)的一種超敏反應(yīng)。由于再次注射相同抗原,抗原和抗體結(jié)合,形成免疫復(fù)合物,中性粒細(xì)胞與免疫復(fù)合物發(fā)生反應(yīng),釋放損傷性物質(zhì),破壞周圍的組織。如果免疫復(fù)合物沉積在皮膚,會(huì)使皮膚發(fā)紅、水腫、甚至壞死。
由此可見,第二次接種后的反應(yīng)同樣需要關(guān)注!
是否會(huì)出現(xiàn)不良反應(yīng)
不良反應(yīng)的嚴(yán)重程度
還與個(gè)體因素有關(guān)
為什么接種疫苗后會(huì)發(fā)生不良反應(yīng)?原因十分復(fù)雜。除了疫苗產(chǎn)品本身以外,還與人體生理因素和健康狀況有一定的關(guān)系。
在健康狀況較差的情況下接種疫苗,例如,接種者有重度營(yíng)養(yǎng)不良、消耗性疾病等,容易發(fā)生不良反應(yīng)。
接種疫苗后進(jìn)行劇烈運(yùn)動(dòng)和重度體力活動(dòng)后,可能會(huì)加重不良反應(yīng)。
接種疫苗后飲酒、睡眠不足等也可能會(huì)加重不良反應(yīng)。
而存在免疫異常的人群,例如患有免疫缺陷癥、HIV感染者、器官或造血干細(xì)胞移植者、使用免疫抑制劑者等等,在接種疫苗前都需要進(jìn)行更詳細(xì)的評(píng)估。
看到這里,會(huì)發(fā)現(xiàn)可能引起疫苗不良反應(yīng)的因素還挺多。但事實(shí)上,不同的疫苗產(chǎn)品包含的成分不完全相同,而每一種疫苗中所含成分的種類有限,對(duì)這些成分會(huì)出現(xiàn)過(guò)敏的人數(shù)有限,因此最終出現(xiàn)不良反應(yīng)的比例極低。
另一方面,“拋開劑量談毒性,都是耍流氓”,疫苗中過(guò)敏源的含量一般很低,只有對(duì)這些過(guò)敏源有很強(qiáng)反應(yīng)的人,才可能會(huì)在接種后出現(xiàn)過(guò)敏癥狀。
要想充分了解疫苗的不良反應(yīng)
監(jiān)測(cè)很重要!
相比其他藥品,社會(huì)各界對(duì)疫苗安全性監(jiān)測(cè)的要求更高。世界衛(wèi)生組織(WHO)在《免疫接種安全性監(jiān)測(cè)》中,對(duì)“預(yù)防接種不良事件”(adverse event following immunization, AEFI)的定義為:預(yù)防接種后發(fā)生的、被認(rèn)為由預(yù)防接種引起的任何不良反應(yīng)。
AEFI可能是真正的不良反應(yīng),確實(shí)是疫苗或免疫接種過(guò)程中引起的結(jié)果;也可能是偶合癥,即,并非是由疫苗或免疫接種過(guò)程引起,而僅在事件上與免疫接種有關(guān)。
WHO將AEFI分為5類:
1、疫苗反應(yīng):由疫苗的某些成分(疫苗本身的活性成分、防腐劑、穩(wěn)定劑等)引起的事件。
2、實(shí)施差錯(cuò):疫苗制備、管理或接種過(guò)程差錯(cuò)引起的事件。
3、偶合事件:發(fā)生于接種后,但不是由疫苗或?qū)嵤┮鸬氖录?/p>
4、注射反應(yīng):對(duì)注射本身焦慮,而非疫苗引起的事件。
5、原因不明的反應(yīng):原因無(wú)法確定的事件。
AEFI監(jiān)測(cè)是各國(guó)衛(wèi)生部門、疫苗生產(chǎn)企業(yè)、銷售企業(yè)、疾控機(jī)構(gòu)和接種單位的共同職責(zé),各國(guó)都建立了各自的AEFI報(bào)告體系。建立和完善AEFI監(jiān)測(cè)系統(tǒng),盡可能收集疫苗在應(yīng)用過(guò)程中發(fā)生的不良事件信息,可以有效評(píng)價(jià)上市疫苗的安全性,也可以增強(qiáng)公眾對(duì)預(yù)防接種的信心。
根據(jù)識(shí)別和報(bào)告AEFI方式的不同,可將AEFI監(jiān)測(cè)分為被動(dòng)監(jiān)測(cè)和主動(dòng)監(jiān)測(cè)兩類。被動(dòng)監(jiān)測(cè)是由醫(yī)務(wù)人員或公眾報(bào)告任何懷疑與疫苗有關(guān)的不良事件;主動(dòng)監(jiān)測(cè)是通過(guò)系統(tǒng)地查找目標(biāo)人群中的AEFI病例,獲得AEFI的發(fā)生情況及發(fā)生率。后者多在疫苗臨床研究或?qū)n}調(diào)查中采用。
在實(shí)際工作中,兩種監(jiān)測(cè)方法會(huì)綜合運(yùn)用。例如,我國(guó)設(shè)有急性弛緩性麻痹監(jiān)測(cè)系統(tǒng),既有常規(guī)病例因癥狀就診時(shí)的醫(yī)務(wù)人員被動(dòng)報(bào)告,也有疾控機(jī)構(gòu)人員定期到醫(yī)療機(jī)構(gòu)開展的主動(dòng)調(diào)查。
我國(guó)于2005年6月1日正式實(shí)施《疫苗流通和預(yù)防接種管理?xiàng)l例》。2010年《全國(guó)疑似預(yù)防接種異常反應(yīng)監(jiān)測(cè)方案》(以下簡(jiǎn)稱《監(jiān)測(cè)方案》)下發(fā)后,中國(guó)AEFI監(jiān)測(cè)的工作日趨規(guī)范。我國(guó)《監(jiān)測(cè)方案》對(duì)AEFI的分類與WHO有所不同:
1、不良反應(yīng):合格的疫苗在實(shí)施規(guī)范接種后,發(fā)生與預(yù)防接種目的無(wú)關(guān)或意外的有害反應(yīng),包括一般反應(yīng)和異常反應(yīng)。
一般反應(yīng):在預(yù)防接種后發(fā)生的,由疫苗本身所固有的特性引起的,對(duì)機(jī)體只會(huì)造成一過(guò)性生理功能障礙的反應(yīng),不會(huì)留下任何后遺癥。(注:主要包括發(fā)熱、乏力、局部紅腫、疼痛等非特異性免疫損害)
異常反應(yīng):合格的疫苗,在實(shí)施規(guī)范接種過(guò)程中或者實(shí)施規(guī)范接種后,造成受種者機(jī)體組織器官、功能損害,相關(guān)各方均無(wú)過(guò)錯(cuò)的藥品不良反應(yīng)。(注:異常反應(yīng)以超敏反應(yīng)最常見)
2、疫苗質(zhì)量事故:由于疫苗質(zhì)量不合格,接種后造成受種者機(jī)體組織器官、功能損害。
3、接種事故:在預(yù)防接種實(shí)施過(guò)程中,違反預(yù)防接種工作規(guī)范、免疫程序、疫苗使用指導(dǎo)原則、接種方案,造成受種者機(jī)體組織器官、功能損害。
4、心因性反應(yīng):在預(yù)防接種實(shí)施過(guò)程中或接種后,因受種者心理因素發(fā)生的個(gè)體或者群體的反應(yīng)。
5、偶合癥:受種者在接種時(shí)正處于某種疾病的潛伏期或前驅(qū)期,接種后巧合發(fā)病。
從上面的AEFI監(jiān)測(cè)分類,我們可以看出,嚴(yán)格意義上,AEFI的分類有許多種。而狹義上的AEFI,主要就是指WHO分類中的“疫苗反應(yīng)”或者我國(guó)《監(jiān)測(cè)方案》中的“不良反應(yīng)”。
全球范圍內(nèi),以美國(guó)的疫苗監(jiān)測(cè)體系較為完善。美國(guó)疫苗上市后不良事件監(jiān)測(cè)工作開始于20世紀(jì)60年代。1990年,美國(guó)疾病預(yù)防和控制中心CDC與FDA聯(lián)合建立了疫苗不良事件報(bào)告系統(tǒng)VAERS(The Vaccine Adverse Event Reporting System,VAERS),由兩個(gè)部門協(xié)作管理。

https://vaers.hhs.gov
VAERS是一個(gè)疫苗上市后安全監(jiān)測(cè)的自愿報(bào)告系統(tǒng),其接收的報(bào)告主要來(lái)源于:疫苗生產(chǎn)者、醫(yī)療衛(wèi)生從業(yè)人員、國(guó)家免疫計(jì)劃、疫苗接種者(或其家人/監(jiān)護(hù)人),也有其他信息來(lái)源。報(bào)告者可以直接通過(guò)官方網(wǎng)站下載VAERS表格報(bào)告,也可以撥打電話獲得VAERS表格,或使用表格的復(fù)印件,所有數(shù)據(jù)都被收集到VAERS數(shù)據(jù)庫(kù)中。其中,美國(guó)對(duì)嚴(yán)重不良事件的定義是:①引起死亡,②危及生命,③導(dǎo)致住院或延長(zhǎng)住院時(shí)間,或④造成永久性喪殘。
我國(guó)的AEFI監(jiān)測(cè)工作由國(guó)家衛(wèi)生主管部門和藥品監(jiān)督管理部門共同負(fù)責(zé)。報(bào)告實(shí)行屬地化管理。醫(yī)療機(jī)構(gòu)、接種單位、疾病預(yù)防控制機(jī)構(gòu)、藥品不良反應(yīng)監(jiān)測(cè)機(jī)構(gòu)、疫苗生產(chǎn)企業(yè)等責(zé)任報(bào)告單位和報(bào)告人發(fā)現(xiàn)AEFI后,及時(shí)向所在地的縣(區(qū)、市、旗,下同)級(jí)疾病預(yù)防控制中心(CDC)報(bào)告,縣級(jí)CDC將AEFI個(gè)案報(bào)告卡和調(diào)查表信息通過(guò)全國(guó)AEFI信息管理系統(tǒng)進(jìn)行網(wǎng)絡(luò)報(bào)告,具有報(bào)告條件的接種單位可以直接將AEFI個(gè)案報(bào)告卡信息錄入全國(guó)AEFI信息管理系統(tǒng)。我國(guó)對(duì)嚴(yán)重AEFI的定義與美國(guó)基本相同:是指導(dǎo)致死亡、危及生命、導(dǎo)致永久或顯著的傷殘或器官功能損傷的AEFI。
新冠疫苗的不良事件發(fā)生率究竟有多少呢?
目前,在我國(guó)獲批的新冠疫苗中,以復(fù)星醫(yī)藥的mRNA新冠疫苗(注:即輝瑞/BioNTech的BNT162b2 mRNA疫苗)的數(shù)據(jù)較為完善。2020年11月,《新英格蘭醫(yī)學(xué)雜志》發(fā)表BNT162b2 mRNA疫苗的II/III期臨床試驗(yàn)結(jié)果[4]。
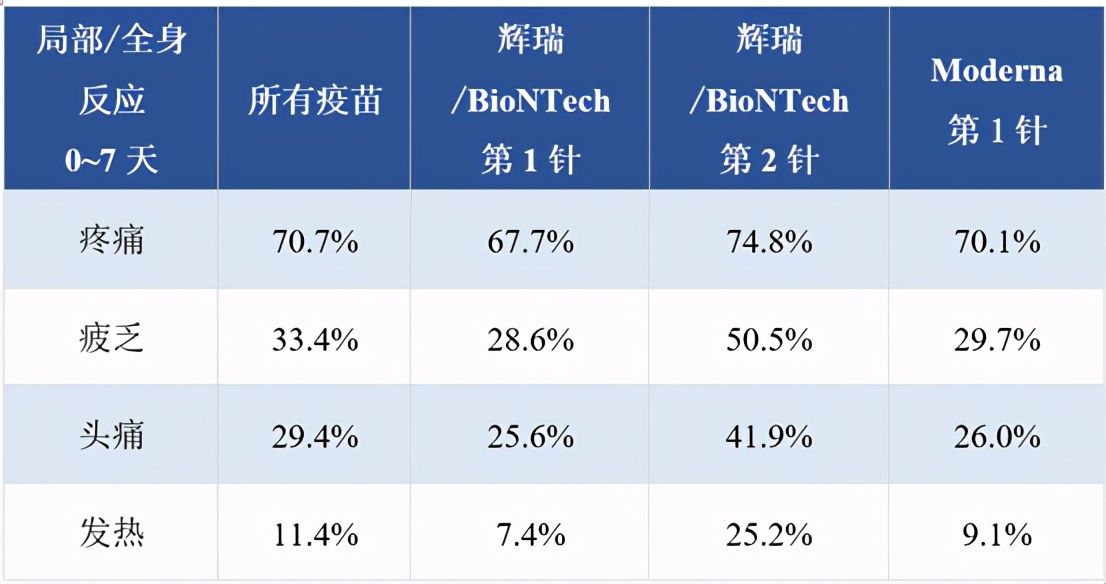
試驗(yàn)最終納入年齡≥16歲的43,448名受試者,按1:1分為mRNA疫苗組(21,720名)和安慰劑組(21,728名)。局部和全身反應(yīng)的評(píng)估數(shù)據(jù)如下:

可見注射疫苗后最常見的局部不良反應(yīng)是注射部位疼痛,而全身反應(yīng)常為疲乏和頭痛(注:這兩者都屬于非特異性免疫反應(yīng)),年齡較長(zhǎng)者的反應(yīng)發(fā)生率均低于年齡較輕者。局部反應(yīng)多為輕中度,1~2天好轉(zhuǎn)。全身反應(yīng)方面,0.2%的患者接種第一針后出現(xiàn)高熱(38.9℃~40℃),0.8%的患者接種第二針后出現(xiàn)高熱,有2名患者發(fā)熱超過(guò)40℃。發(fā)熱和寒戰(zhàn)多在接種后1~2天內(nèi)出現(xiàn),癥狀可在短期內(nèi)緩解。
對(duì)所有受試者進(jìn)行不良事件監(jiān)測(cè),疫苗接種組中,有27%的受試者報(bào)告了不良事件(任何形式),很大部分是接種后短時(shí)間的局部或全身反應(yīng)。有64名(0.3%)疫苗組受試者報(bào)告了淋巴結(jié)病;疫苗組出現(xiàn)4例嚴(yán)重不良事件(疫苗相關(guān)的肩部損傷、右腋窩淋巴結(jié)病、陣發(fā)性室性心律失常、右下肢感覺異常),2例受試者死亡,研究者調(diào)查后表示與接種疫苗無(wú)關(guān)。
隨著接種mRNA疫苗人數(shù)的增加,相關(guān)數(shù)據(jù)也日趨完善,美國(guó)CDC還開發(fā)了一款A(yù)PP來(lái)幫助疫苗接種后的監(jiān)測(cè)(v-safe)。

2021年1月27日,美國(guó)CDC發(fā)布了VAERS最新的新冠疫苗安全性監(jiān)測(cè)數(shù)據(jù)[5],部分?jǐn)?shù)據(jù)如下:
根據(jù)VAERS的數(shù)據(jù),每百萬(wàn)次注射mRNA新冠疫苗,約有372次出現(xiàn)不嚴(yán)重的過(guò)敏事件(0.0372%)。結(jié)合上面的局部和全身反應(yīng)數(shù)據(jù),我們可以看出,多低于臨床試驗(yàn)的結(jié)果。這種情況很大程度上和“被動(dòng)監(jiān)測(cè)”這種方式有關(guān)。舉例來(lái)說(shuō),如果接種疫苗后出現(xiàn)輕度、短暫的局部疼痛或疲乏,經(jīng)過(guò)休息后就能好轉(zhuǎn),這時(shí)候,部分接種者并不會(huì)去報(bào)告。因此,不良事件發(fā)生率的估計(jì),以臨床試驗(yàn)或?qū)n}調(diào)查數(shù)據(jù)更為準(zhǔn)確,它們均是在研究者的密切觀察下進(jìn)行,是“主動(dòng)監(jiān)測(cè)”。VAERS也鼓勵(lì)醫(yī)生和其他疫苗相關(guān)人員報(bào)告不良事件,以獲得更可靠的數(shù)據(jù)。
2021年2月16日,Nature網(wǎng)站發(fā)布文章[6],討論了新冠疫苗不良反應(yīng)的相關(guān)問(wèn)題。對(duì)于罕見但嚴(yán)重的過(guò)敏反應(yīng),我們到底了解多少?
根據(jù)VAERS數(shù)據(jù),Moderna mRNA疫苗每百萬(wàn)劑可出現(xiàn)3次嚴(yán)重的過(guò)敏事件(0.0003%),輝瑞/BioNTech mRNA疫苗每百萬(wàn)劑可出現(xiàn)5次嚴(yán)重的過(guò)敏事件(0.0005%),對(duì)于牛津-阿斯利康疫苗(腺病毒載體疫苗),在截止目前的300多萬(wàn)例接種中,已經(jīng)證實(shí)有30例嚴(yán)重過(guò)敏反應(yīng)。
近兩日,丹麥報(bào)道有接種牛津阿斯利康腺病毒新冠疫苗者出現(xiàn)嚴(yán)重血栓事件,多國(guó)暫停接種該疫苗,引發(fā)各界擔(dān)憂。為此,3月11日,歐洲藥品管理局(EMA)表示,目前尚沒有證據(jù)表明血栓事件與疫苗接種有關(guān),在接種疫苗人群中發(fā)生血栓事件的數(shù)量不高于普通人群中的數(shù)量。EMA藥物警戒風(fēng)險(xiǎn)評(píng)估委員會(huì)(PRAC)已經(jīng)在審查阿斯利康疫苗的血栓不良事件,但是也表示由于疫苗的獲益高于風(fēng)險(xiǎn),故在血栓事件調(diào)查期間,該疫苗仍可以使用。[7]
這些疫苗引起過(guò)敏反應(yīng)的具體原因尚不清楚,美國(guó)國(guó)家過(guò)敏和傳染病研究所(National Institute of Allergy and Infectious Diseases, NIAID)已經(jīng)設(shè)計(jì)了一項(xiàng)臨床試驗(yàn)來(lái)明確潛在的原因。研究人員懷疑,脂質(zhì)納米顆粒(LNP)中含有的聚乙二醇(PEG)可能是引起過(guò)敏反應(yīng)的物質(zhì)。目前沒有直接歸因于新冠疫苗的死亡事件。
嚴(yán)重不良事件發(fā)生率到底高不高?
那要和既往常用的疫苗比一比!
首先,讓我們來(lái)看看國(guó)內(nèi)幾種常用疫苗的嚴(yán)重不良事件發(fā)生率[8]。
中國(guó)2016年不同疫苗AEFI分類報(bào)告結(jié)果(部分)

注:原表格是以每10萬(wàn)例為單位,為了和其他研究的數(shù)據(jù)統(tǒng)一,方便閱讀,這里改為了每百萬(wàn)例為單位。
根據(jù)2016年中國(guó)疑似預(yù)防接種異常反應(yīng)監(jiān)測(cè)數(shù)據(jù)分析顯示,AEFI總報(bào)告發(fā)生率為3.901/百萬(wàn)例(包括一般反應(yīng)和異常反應(yīng),0.03901%),其中嚴(yán)重AEFI發(fā)生率為1.6/百萬(wàn)例(0.00016%)。
再來(lái)看一項(xiàng)全球性的研究數(shù)據(jù)[9]。
2009年~2011年間的25,173,965例疫苗接種,共確認(rèn)33例嚴(yán)重過(guò)敏反應(yīng)(注:該研究中對(duì)嚴(yán)重過(guò)敏反應(yīng)的定義,是指急性、全身性、多器官系統(tǒng)受累、具有潛在致命性的過(guò)敏反應(yīng)),發(fā)生率約為1.31/每百萬(wàn)接種(0.00013%)。數(shù)據(jù)如下:
全球幾種常用疫苗的嚴(yán)重超敏反應(yīng)的發(fā)生率(部分)

而上文中提到,根據(jù)VAERS檢測(cè)數(shù)據(jù),注射mRNA新冠疫苗的嚴(yán)重不良事件發(fā)生率為0.0003%~0.0005%,因此,mRNA疫苗的嚴(yán)重不良事件發(fā)生率高于既往常用疫苗的總體水平。
但是,不同的疫苗,嚴(yán)重AEFI的發(fā)生率也存在一定差異,mRNA疫苗并沒有超過(guò)既往單個(gè)疫苗的高值。當(dāng)然,由于mRNA疫苗的應(yīng)用時(shí)間尚短,它的長(zhǎng)期安全性等尚未解答的問(wèn)題,還需要經(jīng)歷更長(zhǎng)的考驗(yàn)。
相比mRNA疫苗,重組腺病毒載體疫苗和滅活疫苗的大樣本量、完整公布的數(shù)據(jù)較少,這里就分享兩個(gè)正式發(fā)表的數(shù)據(jù)。2020年8月,重組腺病毒載體新冠疫苗的II期臨床試驗(yàn)結(jié)果發(fā)表在《柳葉刀》[10],共納入508名符合要求的志愿者,其中253人接種高劑量疫苗(1×10^11 病毒顆粒),129人接種低劑量疫苗(5×10^10 病毒顆粒),126人接種安慰劑。不良事件評(píng)估主要結(jié)果如下:

注:未發(fā)現(xiàn)嚴(yán)重不良事件發(fā)生。
科興的新冠滅活疫苗I/II期臨床試驗(yàn)結(jié)果,于2021年2月在《柳葉刀·感染》(Lancet infection)上公布[11]。試驗(yàn)納入≥60歲的健康志愿者,觀察期為28天,給予患者3種不同的接種劑量,分別為1.5 μg組、3 μg組、6 μg組。安全性結(jié)果顯示每組出現(xiàn)任何不良事件的發(fā)生率分別為:

所有不良事件均為輕中度,注射部位疼痛是最常見的癥狀,發(fā)生率為9%(39/421名),發(fā)熱的發(fā)生率為3%(14名/421名),同時(shí)未見有疫苗相關(guān)的嚴(yán)重不良事件發(fā)生。
嚴(yán)重過(guò)敏反應(yīng)的發(fā)生率極低
一般反應(yīng)似乎也不少
如果出現(xiàn)不良反應(yīng),該如何應(yīng)對(duì)?
一、一般反應(yīng)
1、局部反應(yīng),包括注射部位的疼痛、紅腫等,多在注射疫苗12~24小時(shí)出現(xiàn),紅腫范圍一般不大,僅有少數(shù)人紅腫直徑>5 cm,這種情況一般在24~48小時(shí)逐步消退。輕度的局部反應(yīng)無(wú)需處理,紅腫的早期可以局部冷敷,減少組織充血。
2、全身反應(yīng),包括發(fā)熱、疲乏等,一般持續(xù)1~2天,少數(shù)患者還會(huì)出現(xiàn)惡心、嘔吐、腹瀉等胃腸道癥狀,一般接種當(dāng)天多見,很少有持續(xù)2~3天的。發(fā)生輕度的全身反應(yīng)后,加強(qiáng)觀察,一般不需要特殊處理,適當(dāng)休息,多喝開水,注意保暖。癥狀較重者,可以根據(jù)情況使用退熱劑等藥物,必要時(shí)送醫(yī)院觀察治療。
二、異常反應(yīng)(主要就是指過(guò)敏反應(yīng))
1、癥狀較輕者觀察即可,無(wú)需用藥。如果出現(xiàn)瘙癢、皮膚潮紅、蕁麻疹等,醫(yī)生會(huì)根據(jù)情況給予患者口服抗組胺藥H2受體拮抗劑、糖皮質(zhì)激素等治療;如果出現(xiàn)支氣管痙攣的癥狀,例如胸悶、憋氣等,可吸入短效β2受體激動(dòng)劑,并聯(lián)系轉(zhuǎn)急診中心繼續(xù)觀察治療。除了上述的癥狀,還可能發(fā)生濕疹、水腫、紫癜等,一般無(wú)明顯急性不適癥狀,無(wú)需采取緊急措施,可根據(jù)情況安排患者至相應(yīng)專科就診。
2、急性嚴(yán)重的過(guò)敏反應(yīng),即過(guò)敏性休克:及其罕見,但是一旦發(fā)生,可危及生命。主要表現(xiàn)為低血壓、大汗、皮膚蒼白、呼吸困難、暈厥、意識(shí)不清等,發(fā)展非常迅速,可在疫苗接種后幾分鐘內(nèi)發(fā)生,多在30分鐘內(nèi),極少超過(guò)1小時(shí),這也是為何要求在接種疫苗后留觀至少30分鐘。
如果發(fā)生過(guò)敏性休克,腎上腺素是最優(yōu)先緊急處理的藥物,同時(shí)需維持氣道和呼吸,監(jiān)護(hù)輸液等。部分疫苗接種點(diǎn)的緊急醫(yī)療保障能力有限,需在保證緊急搶救的情況下,轉(zhuǎn)去急診醫(yī)療中心繼續(xù)治療。
3、其他較嚴(yán)重的過(guò)敏反應(yīng)是十分罕見的。例如過(guò)敏性紫癜、Arthus反應(yīng)、吉蘭巴雷綜合征、腦脊髓膜炎等,可在接種后數(shù)日或數(shù)周發(fā)病。一旦發(fā)病,需要去相應(yīng)專科評(píng)估就診和治療。
疫苗在人類和疾病的抗?fàn)幹邪缪萘伺e足輕重的角色,是舉世公認(rèn)的最經(jīng)濟(jì)、方便、有效的預(yù)防和控制傳染病的手段。但是,沒有任何一種疫苗可以達(dá)到絕對(duì)的安全(就好像世上沒有絕對(duì)的自由)。
由于疫苗的接種對(duì)象主要是健康人群,因此公眾承擔(dān)風(fēng)險(xiǎn)的能力較弱,人們對(duì)疫苗安全性的要求更高。很多時(shí)候,對(duì)一種事物的恐懼和不信任,很大程度上來(lái)源于“不了解”。因此,盡可能讓大家理解疫苗的作用機(jī)制,盡可能公布疫苗接種的相關(guān)數(shù)據(jù),讓大家明白疫苗帶來(lái)的獲益遠(yuǎn)高于風(fēng)險(xiǎn),是增強(qiáng)對(duì)免疫接種信心的重點(diǎn)。當(dāng)然,對(duì)新型疫苗安全性的評(píng)估,我們還有很多問(wèn)題需要時(shí)間去解答。總體來(lái)說(shuō),疫苗是絕大多數(shù)人的“天使”。
作者 (同濟(jì)大學(xué)醫(yī)學(xué)院內(nèi)科學(xué)碩士)
| 版權(quán)聲明: 1.依據(jù)《服務(wù)條款》,本網(wǎng)頁(yè)發(fā)布的原創(chuàng)作品,版權(quán)歸發(fā)布者(即注冊(cè)用戶)所有;本網(wǎng)頁(yè)發(fā)布的轉(zhuǎn)載作品,由發(fā)布者按照互聯(lián)網(wǎng)精神進(jìn)行分享,遵守相關(guān)法律法規(guī),無(wú)商業(yè)獲利行為,無(wú)版權(quán)糾紛。 2.本網(wǎng)頁(yè)是第三方信息存儲(chǔ)空間,阿酷公司是網(wǎng)絡(luò)服務(wù)提供者,服務(wù)對(duì)象為注冊(cè)用戶。該項(xiàng)服務(wù)免費(fèi),阿酷公司不向注冊(cè)用戶收取任何費(fèi)用。 名稱:阿酷(北京)科技發(fā)展有限公司 聯(lián)系人:李女士,QQ468780427 網(wǎng)絡(luò)地址:www.arkoo.com 3.本網(wǎng)頁(yè)參與各方的所有行為,完全遵守《信息網(wǎng)絡(luò)傳播權(quán)保護(hù)條例》。如有侵權(quán)行為,請(qǐng)權(quán)利人通知阿酷公司,阿酷公司將根據(jù)本條例第二十二條規(guī)定刪除侵權(quán)作品。 |
 m.quanpro.cn
m.quanpro.cn